Fenómenos o Cambios Físicos: Son procesos en los que no cambia la naturaleza de las sustancias ni se forman otras nuevas.
Ejemplos:
- Cambios de estado: Si aplicamos una fuente de calor de forma constante, el agua hierve y se transforma en vapor de agua. (En ambos casos, la sustancia implicada en el proceso es agua que, en un caso está líquida y en el otro está gaseosa; esto es, sus partículas están ordenadas de diferente manera según la teoría cinética de la materia).
Fenómenos o Cambios Químicos: Son procesos en los que cambia la naturaleza de las sustancias, además de formarse otras nuevas.
Ejemplos:
- Combustión: Si quemamos un papel, se transforma en cenizas y, durante el proceso, se desprende humo. (Inicialmente, tendríamos papel y oxígeno, al concluir el cambio químico tenemos cenizas y dióxido de carbono, sustancias diferentes a las iniciales).
- Corrosión: Si dejamos un trozo de hierro a la intemperie, se oxida y pierde sus propiedades iniciales. (Las sustancias iniciales serían hierro y oxígeno, la sustancia final es óxido de hierro, con unas propiedades totalmente diferentes a las de las sustancias iniciales).
Número de Avogadro
| Valores de NA[1] | Unidades |
|---|---|
| 6.022 141 79(30)×1023 | mol−1 |
| 2.731 597 57(14)×1026 | lb-mol.−1 |
| 1.707 248 479(85)×1025 | oz-mol.−1 |
| Para más detalles, ver Terminología y unidades más adelante. | |
En 2006, la CODATA recomendó este valor de:[1]
El valor de la constante de Avogadro fue indicado en primer lugar por Johann Josef Loschmidt que, en 1865, estimó el diámetro medio de las moléculas en el aire por un método equivalente a calcular el número de partículas en un volumen determinado de gas.[7] Este último valor, la densidad numérica de partículas en un gas ideal, que ahora se llama en su honor constante de Loschmidt, es aproximadamente proporcional a la constante de Avogadro. La conexión con Loschmidt es la raíz del símbolo L que a veces se utiliza para la constante de Avogadro, y la literatura en lengua germana puede referirse a ambas constantes con el mismo nombre, distinguiéndolas solamente por las unidades de medida.[8]
http://es.wikipedia.org/wiki/N%C3%BAmero_de_Avogadro
Un catalizador propiamente dicho es una sustancia que está presente en una reacción química en contacto físico con los reactivos, y acelera, induce o propicia dicha reacción sin actuar en la misma.
Tipos de catálisis
Los catalizadores pueden ser homogéneos o heterogéneos, dependiendo de si existe un catalizador en la misma fase que el sustrato. Los biocatalizadores son vistos a menudo como un grupo separado.Catalizadores heterogéneo

Catalizadores sólidos heterogéneos como los convertidores catalíticos de los automóviles están colocados en estructuras diseñadas para maximizar su área superficial.
Catalizadores homogéneos
Normalmente los catalizadores homogéneos están disueltos en un disolvente con los sustratos. Un ejemplo de catálisis homogénea implica la influencia de H+ en la esterificación de los ésteres, por ejemplo, acetato de metilo a partir del ácido acético y el metanol.[9] Para los químicos inorgánicos, la catálisis homogénea es a menudo sinónimo de catalizadores organometálicos.[10]
http://es.wikipedia.org/wiki/Cat%C3%A1lisis#Tipos_de_cat.C3.A1lisis
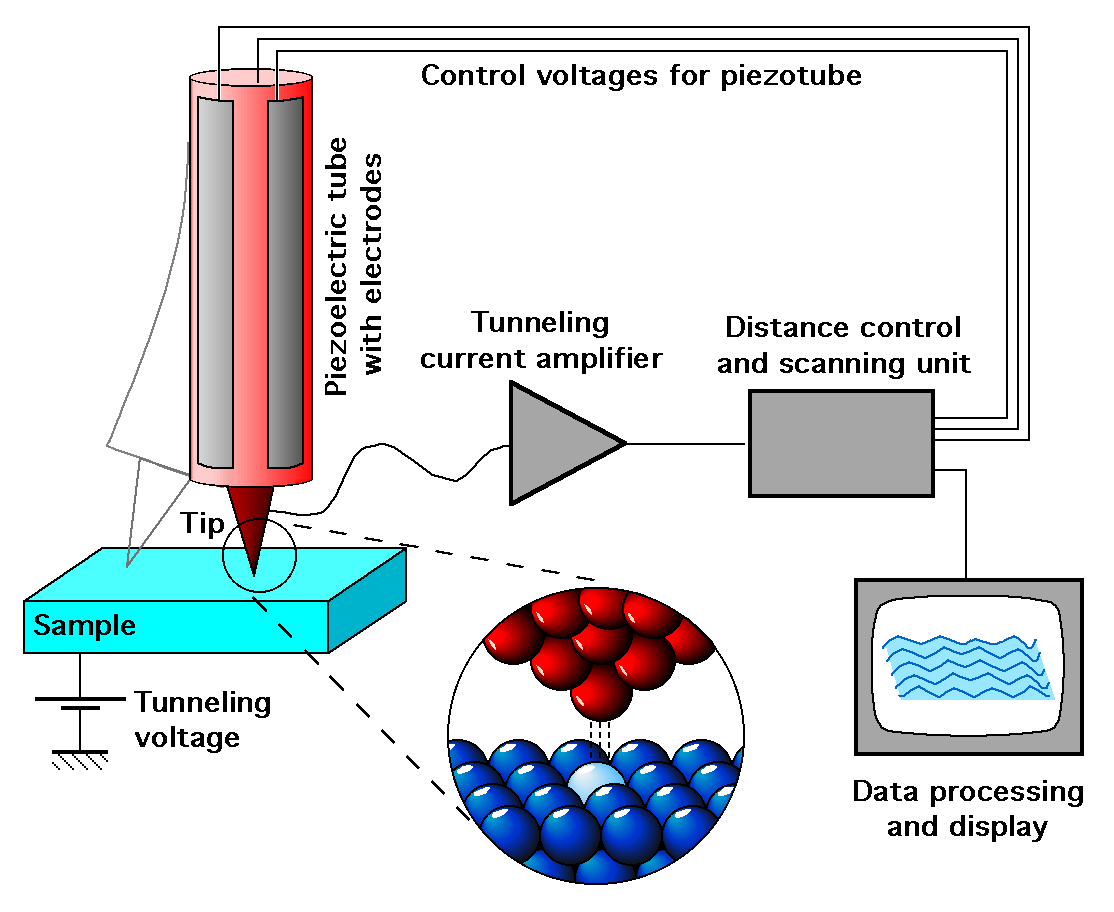
Microscopio de efecto túnel
El microscopio de efecto túnel (Scanning Tunneling Microscope STM) o microscopio ciego es un poderoso instrumento que perEl efecto túnel
Desde el punto de vista de la mecánica clásica un electrón no puede superar una barrera de potencial superior a su energía.
Sin embargo, según la mecánica cuántica, los electrones no están definidos por una posición precisa, sino por una nube de probabilidad. Esto provoca que en ciertos sistemas esta nube de probabilidad se extienda hasta el otro lado de una barrera de potencial. Por tanto el electrón puede atravesar la barrera, y contribuir a generar una intensidad eléctrica.
Esta intensidad se denomina intensidad de túnel y es el parámetro de control que nos permite realizar la topografía de superficie.
Este efecto cuántico aparece también en otras ramas de la física. Gamow lo aplicó para dar explicación a la desintegración mediante emisión de partículas alfa en núcleos inestables. En electrónica, hay transistores que basan parte de su funcionamiento en el efecto túnel.
mite visualizar superficies a escala del átomo.
http://es.wikipedia.org/wiki/Microscopio_de_efecto_t%C3%BAnel
El mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de Unidades.
Dada cualquier sustancia (elemento químico, compuesto o material) y considerando a la vez un cierto tipo de entidades elementales que la componen, se define como un mol a la cantidad de esa sustancia que contiene tantas entidades elementales del tipo considerado, como átomos hay en 12 gramos de carbono-12. Esta definición no aclara a qué se refiere con cantidad de sustancia y su interpretación es motivo de debates,[1] aunque normalmente se da por hecho que se refiere al número de entidades.
El número de unidades elementales –átomos, moléculas, iones, electrones, radicales u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro (NA)[2] y equivale a:
http://es.wikipedia.org/wiki/Mol
Paola Elizabeth Bautista Perez
Desde el punto de vista de la mecánica clásica un electrón no puede superar una barrera de potencial superior a su energía.
Sin embargo, según la mecánica cuántica, los electrones no están definidos por una posición precisa, sino por una nube de probabilidad. Esto provoca que en ciertos sistemas esta nube de probabilidad se extienda hasta el otro lado de una barrera de potencial. Por tanto el electrón puede atravesar la barrera, y contribuir a generar una intensidad eléctrica.
Esta intensidad se denomina intensidad de túnel y es el parámetro de control que nos permite realizar la topografía de superficie.
Este efecto cuántico aparece también en otras ramas de la física. Gamow lo aplicó para dar explicación a la desintegración mediante emisión de partículas alfa en núcleos inestables. En electrónica, hay transistores que basan parte de su funcionamiento en el efecto túnel.
mite visualizar superficies a escala del átomo.

http://es.wikipedia.org/wiki/Microscopio_de_efecto_t%C3%BAnel
| mol | |
Dada cualquier sustancia (elemento químico, compuesto o material) y considerando a la vez un cierto tipo de entidades elementales que la componen, se define como un mol a la cantidad de esa sustancia que contiene tantas entidades elementales del tipo considerado, como átomos hay en 12 gramos de carbono-12. Esta definición no aclara a qué se refiere con cantidad de sustancia y su interpretación es motivo de debates,[1] aunque normalmente se da por hecho que se refiere al número de entidades.
El número de unidades elementales –átomos, moléculas, iones, electrones, radicales u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro (NA)[2] y equivale a:
|
Paola Elizabeth Bautista Perez
Microscopio
El microscopio (de micro-, μικρο, pequeño, y scopio, σκοπεω, observar) es un instrumento que permite observar objetos que son demasiado pequeños para ser vistos a simple vista. El tipo más común y el primero que se inventó es el microscopio óptico. Se trata de un instrumento óptico que contiene una o varias lentes que permiten obtener una imagen aumentada del objeto y que funciona por refracción.
La ciencia que investiga los objetos pequeños utilizando este instrumento se llama microscopía.
La ciencia que investiga los objetos pequeños utilizando este instrumento se llama microscopía.


No hay comentarios:
Publicar un comentario